一、全國醫療器械不良事件報告總體情況
2016年,全國醫療器械不良事件監測工作繼續穩步發展,全年可(kě)疑醫療器械不良事件報告數已超過35萬份。在報告數量持續增長(cháng)的(de)同時(shí),報告質量也(yě)不斷提升,爲醫療器械上市後風險的(de)分(fēn)析與評價提供了(le)依據。
(一)2016年全國可(kě)疑不良事件報告總體情況
1、2002年至2016年全國可(kě)疑不良事件報告數量
2016年,國家藥品不良反應監測中心共收到《可(kě)疑醫療器械不良事件報告表》353240份,比2015年增長(cháng)了(le)10.0%(圖1-1)。2002年1月(yuè)1日至2016年12月(yuè)31日,國家藥品不良反應監測中心累計收到《可(kě)疑醫療器械不良事件報告表》1,675,299份。
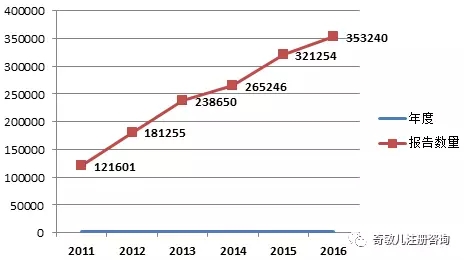
圖1-1 2011-2015年全國可(kě)疑醫療器械不良事件報告數量
2、死亡及嚴重傷害可(kě)疑不良事件報告數量
2016年,國家藥品不良反應監測中心共收到嚴重傷害可(kě)疑不良事件報告52,331份,死亡可(kě)疑不良事件報告181份,共計52,512份,比2015年增長(cháng)了(le)11.1%(圖1-2)。2016年死亡及嚴重傷害可(kě)疑不良事件報告數量占報告總數的(de)比例爲14.9%,比2015年增長(cháng)了(le)0.2%。
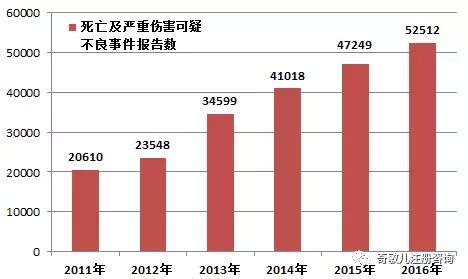
圖1-2 2011-2016年全國死亡及嚴重傷害可(kě)疑不良事件報告數比較
3、每百萬人(rén)口平均報告數量
2016年,我國每百萬人(rén)口平均可(kě)疑醫療器械不良事件報告數爲264份,與2015年相比增長(cháng)了(le)24份(圖1-3)。
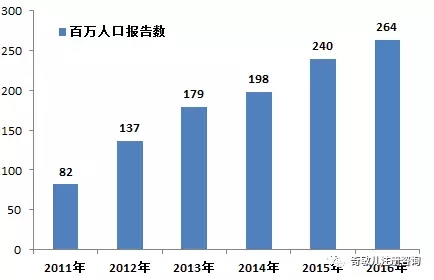
圖1-3 2011-2016年全國每百萬人(rén)口平均報告數比較
(二)注冊基層用(yòng)戶數量
截止2016年12月(yuè)31日,在全國醫療器械不良事件監測系統中,注冊基層用(yòng)戶(包括醫療器械生産企業、經營企業和(hé)使用(yòng)單位)共231,872家。其中,醫療器械生産企業10,534家,占注冊基層用(yòng)戶總數的(de)4.5%;經營企業115,622家,占注冊基層用(yòng)戶的(de)49.9%;使用(yòng)單位105,716家,占注冊基層用(yòng)戶的(de)45.6%(圖1-4)。
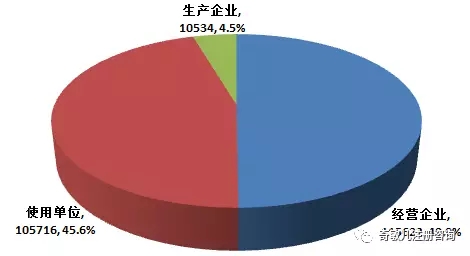
圖1-4 2016年全國醫療器械不良事件監測系統注冊基層用(yòng)戶情況
2016年,注冊基層用(yòng)戶(包括醫療器械生産企業、經營企業和(hé)使用(yòng)單位)總數比2015年增長(cháng)了(le)16.8%。其中,醫療器械生産企業、經營企業和(hé)使用(yòng)單位的(de)注冊基層用(yòng)戶分(fēn)别比2015年增長(cháng)了(le)1.8%、26.6%和(hé)9.1%(圖1-5)。
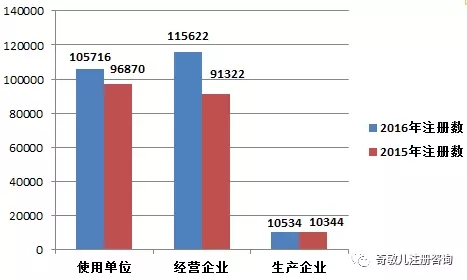
圖1-5 2015年和(hé)2016年全國注冊基層用(yòng)戶分(fēn)類比較情況
二、2016年醫療器械不良事件報告統計分(fēn)析
(一)按報告來(lái)源統計分(fēn)析
2016年,全國上報的(de)可(kě)疑醫療器械不良事件報告中,使用(yòng)單位上報297,435份,占總報告數的(de)84.2%;生産企業上報6,604份,占總報告數的(de)1.9%;經營企業上報49,002份,占總報告數的(de)13.9%;還(hái)有190份報告來(lái)自于個(gè)人(rén),占總報告數的(de)0.05%;此外還(hái)有9份報告來(lái)源不詳(圖2-1)。
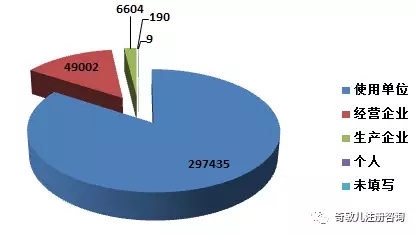
圖2-1 2016年醫療器械不良事件報告來(lái)源情況
總體來(lái)看,不良事件報告仍主要來(lái)源于使用(yòng)單位,其次來(lái)源于經營企業。生産企業提交的(de)報告所占比例不足2%,與其器械使用(yòng)安全第一責任人(rén)的(de)地位不符,其履行職責的(de)自覺性有待提高(gāo)。
(二)按事件傷害程度統計分(fēn)析
2016年,全國上報的(de)可(kě)疑醫療器械不良事件報告中,事件傷害爲死亡的(de)報告共181份,占總報告數的(de)0.05%;事件爲嚴重傷害的(de)報告共52,331份,占總報告數的(de)14.8%;事件傷害爲其他(tā)的(de)報告共300,728份,占總報告數的(de)85.1%(圖2-2)。2016年,各類傷害程度的(de)報告所占比例與2015年基本一緻。
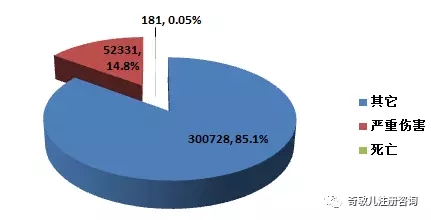
圖2-2 2016年醫療器械不良事件報告事件傷害程度情況
(三)按醫療器械管理(lǐ)類别統計分(fēn)析
2016年,全國上報的(de)可(kě)疑醫療器械不良事件報告中,涉及Ⅲ類醫療器械的(de)報告146,689份,占總報告數的(de)41.5%;涉及Ⅱ類醫療器械的(de)報告148,945份,占總報告數的(de)42.2%;涉及Ⅰ類醫療器械的(de)報告38,728份,占總報告數的(de)11.0%;部分(fēn)報告涉及的(de)器械管理(lǐ)類别不詳,共18,878份,占總報告數的(de)5.3%。數據顯示,涉及Ⅲ類和(hé)Ⅱ類醫療器械的(de)報告占絕大(dà)多(duō)數,這(zhè)與醫療器械風險程度高(gāo)低相吻合(圖2-3)。
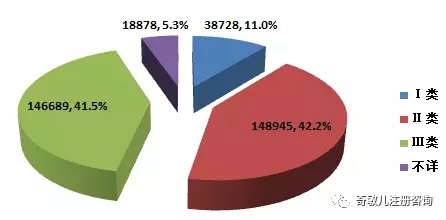
圖2-3 2016年醫療器械不良事件報告涉及産品管理(lǐ)類别情況
(四)按醫療器械分(fēn)類目錄統計分(fēn)析
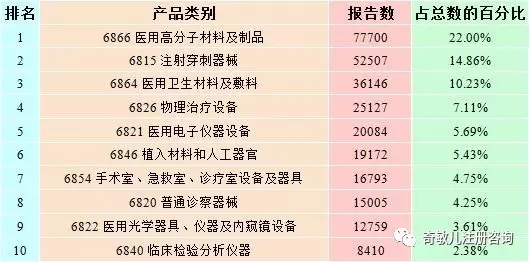
按照(zhào)現行的(de)《醫療器械分(fēn)類目錄》,2016年全國上報的(de)可(kě)疑醫療器械不良事件報告共涉及43類産品,涵蓋了(le)《醫療器械分(fēn)類目錄》中的(de)所有醫療器械類别。其中,報告數量位列前十位的(de)産品類别見表2-1。與2015年相比,報告數量排名前十位的(de)産品類别沒有變化(huà),僅部分(fēn)産品類别的(de)排名略有變化(huà)。
表2-1 2015年醫療器械不良事件報告數量排名前十位的(de)産品類别情況
(五)按醫療器械産品名稱統計分(fēn)析
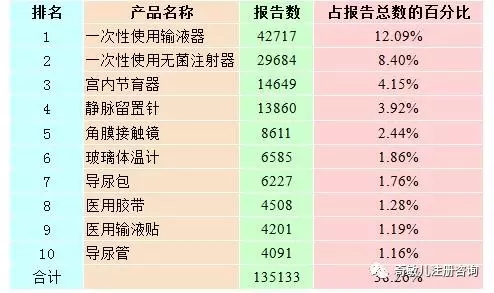
2016年,全國上報的(de)可(kě)疑醫療器械不良事件報告中,報告數量排名前十位的(de)無源醫療器械分(fēn)别爲一次性使用(yòng)輸液器、一次性使用(yòng)無菌注射器、宮内節育器、靜脈留置針、角膜接觸鏡、玻璃體溫計、導尿包、醫用(yòng)膠帶、醫用(yòng)輸液貼和(hé)導尿管,占總報告數的(de)38.26%,詳見表2-2。
表2-2 報告數量排名前十位的(de)無源醫療器械
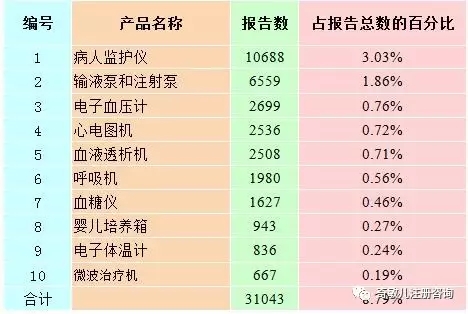
2016年,全國上報的(de)可(kě)疑醫療器械不良事件報告中,報告數量排名前十位的(de)有源醫療器械分(fēn)别爲病人(rén)監護儀、輸液泵和(hé)注射泵、電子血壓計、心電圖機、血液透析機、呼吸機、血糖儀、嬰兒(ér)培養箱、電子體溫計和(hé)微波治療機,占總報告數的(de)8.79%,詳見表2-3。
表2-3 報告數量排名前十位的(de)有源醫療器械
(六)按涉及實際使用(yòng)場(chǎng)所統計分(fēn)析
2016年,全國上報的(de)可(kě)疑醫療器械不良事件報告中,使用(yòng)場(chǎng)所爲“醫療機構”的(de)報告278,561份,占79%;使用(yòng)場(chǎng)所爲“家庭”的(de)報告37,343份,占11%;使用(yòng)場(chǎng)所爲“其他(tā)”的(de)報告7,559份,占2%;使用(yòng)場(chǎng)所未填寫的(de)報告29,777份,占8%(圖2-4)。使用(yòng)場(chǎng)所的(de)複雜(zá)性是分(fēn)析不良事件發生原因時(shí)需要考量的(de)因素之一。
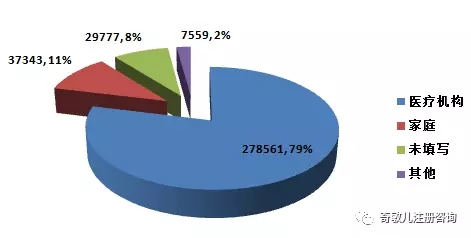
圖2-4 2016年醫療器械不良事件報告涉及實際使用(yòng)場(chǎng)所情況
三、醫療器械不良事件重點監測情況
(一)“十二五”重點監測結果應用(yòng)
“十二五”期間,總局組織對(duì)100個(gè)醫療器械品種開展了(le)重點監測工作,主動收集産品的(de)不良事件信息,分(fēn)析評價暴露的(de)風險,對(duì)發現的(de)值得(de)關注的(de)産品風險,深入分(fēn)析其産生原因,提出針對(duì)性的(de)風險控制措施建議(yì)。總局醫療器械監管司對(duì)這(zhè)些風險控制措施建議(yì)進行了(le)彙總分(fēn)析,并以此爲依據采取了(le)相應的(de)監管措施,将相關的(de)評價結果反饋給生産企業、國家衛計委和(hé)各省局,爲更好的(de)開展醫療器械上市後監管提供參考。
(二)“十三五”重點監測工作情況
2016年,總局在總結“十二五”期間開展100個(gè)品種重點監測經驗基礎之上,精心遴選了(le) “十三五”期間開展的(de)100個(gè)重點監測品種。在遴選品種上,充分(fēn)考慮了(le)産品的(de)風險特點、使用(yòng)狀況、不良事件數據、抽驗中發現的(de)問題、文獻報道中存在風險隐患以及剛上市的(de)創新産品臨床例數少等因素,并邀請臨床、工程學以及總局相關專家對(duì)品種進行多(duō)次討(tǎo)論、篩選,最終予以确定。其中,輸液泵等46個(gè)産品爲“十二五”期間已經開展過的(de)産品,“十三五”期間将針對(duì)“十二五”重點監測中已發現的(de)風險點繼續開展有針對(duì)性的(de)監測。
四、醫療器械不良事件報告質量評估情況
(一)發布《醫療器械不良事件報告表質量評估規定(試行)》
2016年是總局狠抓醫療器械不良事件報告質量的(de)一年。爲落實這(zhè)項工作,2016年6月(yuè)國家中心發布了(le)《醫療器械不良事件報告表質量評估規定(試行)》,爲基層報告單位提升醫療器械不良事件報告的(de)完整性和(hé)準确性提供了(le)具體的(de)參考标準。
該規定明(míng)确了(le)質量評估工作職責、開展質量評估的(de)報告範圍以及具體的(de)報告評分(fēn)标準,可(kě)操作性強。報告的(de)評分(fēn)标準中規定,報告真實性爲否決項。評分(fēn)項目包括報告時(shí)限、報告來(lái)源、患者信息、不良事件情況、器械信息以及評價處理(lǐ)六部分(fēn),共計100分(fēn)。評分(fēn)項目中的(de)不良事件情況和(hé)器械信息爲評分(fēn)重點,分(fēn)别占到46分(fēn)和(hé)34分(fēn),因爲這(zhè)兩部分(fēn)内容爲開展報告的(de)分(fēn)析評價提供了(le)主要信息。
(二)全國醫療器械不良事件報告質量評估工作情況
《醫療器械不良事件報告表質量評估規定(試行)》頒布後,國家中心舉辦了(le)全國醫療器械不良事件報告質量評估培訓班,對(duì)全國31個(gè)省(區(qū)、市)、國家衛生計劃委員(yuán)會、新疆生産建設兵(bīng)團及中國人(rén)民解放軍藥品不良反應監測中心以及所有地市級藥品不良反應監測中心進行了(le)培訓,極大(dà)的(de)提高(gāo)了(le)全國醫療器械不良事件監測體系人(rén)員(yuán)對(duì)報告質量的(de)認識,對(duì)我國醫療器械不良事件監測工作起到了(le)積極的(de)推動作用(yòng)。
按照(zhào)《醫療器械不良事件報告表質量評估規定(試行)》的(de)要求,各省(區(qū)、市)從2016年第三季度起對(duì)本省的(de)醫療器械不良事件報告按季度開展了(le)質量評估工作。
五、2016年醫療器械警戒快(kuài)訊發布情況
2016年,國家藥品不良反應監測中心共發布10期《醫療器械警戒快(kuài)訊》,包括49條國外醫療器械監管機構發布的(de)安全性信息,涉及電子十二指腸鏡、神經外科頭部固定器、人(rén)工膝關節、注射泵、便攜式應急供氧系統等産品。
QME服務範圍:
如需了(le)解最新的(de)法規,獲取專業的(de)法規解讀和(hé)技術咨詢服務,請與我們聯系。
北(běi)京奇敏兒(ér)信息咨詢有限責任公司
地址:北(běi)京市朝陽區(qū)紅軍營南(nán)路15号瑞普大(dà)廈C座602
電話(huà):010-64187881
傳真:010-62270562
郵箱:service@qiminer.com
網址:www.qiminer.com







